近期,保健食品新功能评价试行版刚刚落地;
24项保健食品功能声称也正式亮相。
2023年8月31日,国家市场监管总局、国家卫生健康委、国家中医药局联合发布《允许保健食品声称的保健功能目录非营养素补充剂(2023年版)》及配套文件的公告。
一、允许保健食品声称的保健功能目录
非营养素补充剂(2023年版)

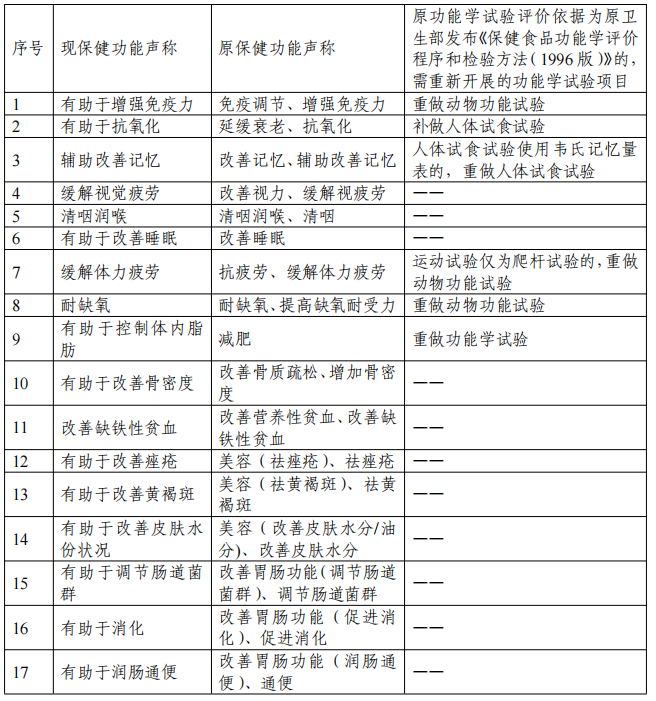
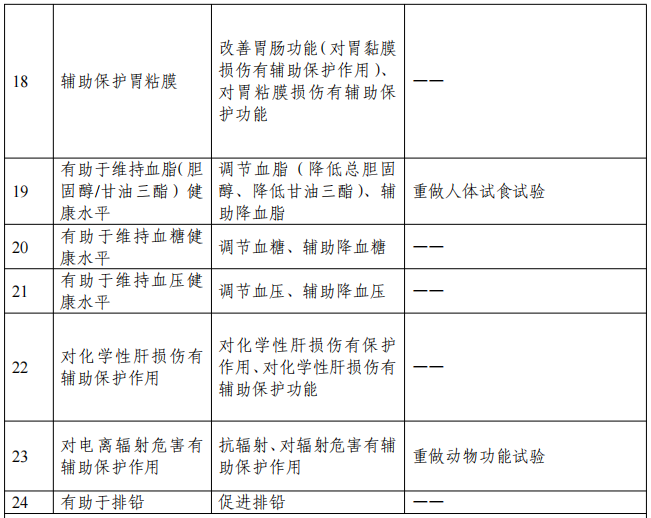
二、新旧保健功能声称对应关系和功能评价衔接要求
注:
一、《保健食品功能检验与评价方法(2023年版)》是在《保健食品检验与评价技术规范(2003年版)》和原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》基础上修订形成,原功能学试验报告评价要求和标准为《保健食品检验与评价技术规范(2003年版)》或原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》的,不需提供保健功能再评价资料。
二、参照既往再注册产品保健功能评价管理要求,原功能学试验报告评价要求和标准低于现行标准要求的,新旧保健功能声称调整时,需提供相应产品的保健功能再评价资料:
1、第三方检验机构出具的上市后人群食用功能学评价研究报告,数据采集、管理、分析应当规范、真实、可溯源,并对产品的保健功能提供有效技术支撑;
2、无法提供上市后人群食用功能学评价研究报告的,可提供按照《保健食品功能检验与评价方法(2023年版)》、原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》或《保健食品检验与评价技术规范(2003年版)》重做的功能学试验报告,其中,原功能学试验报告评价要求和标准为《保健食品功能学评价程序和检验方法(1996版)》的,需重新开展的功能学试验项目见上表要求,“— —”表示不需提供保健功能再评价资料。
解读:
一、起草情况
《中华人民共和国食品安全法》规定,允许保健食品声称的保健功能实行目录管理。2019年发布的《保健食品原料目录与保健功能目录管理办法》对保健功能目录的制定程序、纳入标准和后续调整等内容作出了规定。为推动保健功能目录制定,与原保健食品功能管理制度衔接,规范保健功能声称管理,市场监管总局组织权威技术机构,围绕功能声称、评价方法等内容开展专项研究。
2019年3月、2020年11月分别发布《关于征求调整保健食品保健功能意见的公告》和《关于征求〈允许保健食品声称的保健功能目录 非营养素补充剂〉及其配套文件意见的公告》,在综合社会反馈意见和专家论证意见基础上,制修订《保健食品功能检验与评价技术指导原则》《保健食品功能检验与评价方法》《保健食品人群试食试验伦理审查工作指导原则》等保健功能目录配套文件,进一步建立完善保健功能技术评价支撑体系。
在此基础上,市场监管总局于2022年1月再次公开征求《关于发布〈允许保健食品声称的保健功能目录 非营养素补充剂〉及配套文件的公告(征求意见稿)》意见,根据征求意见情况修改完善后,依法会同国家卫生健康委和国家中医药局发布《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》(以下简称《功能目录非营养素补充剂(2023年版)》)及配套文件和解读。
二、《保健食品功能检验与评价方法(2023年版)》的定位
《保健食品功能检验与评价方法(2023年版)》为《功能目录 非营养素补充剂(2023年版)》配套的检验与评价方法,按照现有保健功能定位系统梳理1995年以来已批准注册的保健功能及配套评价方法,尤其是原卫生部发布的《保健食品检验与评价技术规范(2003年版)》和原食品药品监管局2012年修订发布的《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》,围绕功能声称、评价方法等内容修订形成新版检验与评价方法,并由强制性方法改为推荐性方法。
为落实企业研发主体责任,充分发挥社会资源科研优势,对于已纳入《功能目录 非营养素补充剂(2023年版)》的保健功能,任何个人、企业、科研机构和社会团体在科学研究论证的基础上,可以提出新的功能评价方法,参照功能目录的纳入程序,认可作为功能评价推荐性方法后,可供产品注册时使用。
三、保健功能已列入《功能目录 非营养素补充剂(2023年版)》的产品过渡
对保健功能已列入《功能目录 非营养素补充剂(2023年版)》的产品,本公告发布之日起,设定5年过渡期,规范注册和备案产品的保健功能声称,已发布的《保健食品原料目录》对应的功效按《功能目录 非营养素补充剂(2023年版)》调整,并制定了《新旧保健功能声称对应关系和功能评价衔接要求》(详见附表)。
其中,对于已备案产品,备案人向原备案机构申请变更保健功能名称;对于已批准注册产品,注册证书持有人可单独提出保健功能名称变更注册,也可在办理其他变更、延续注册等申请事项时转换原保健功能声称;对于在审产品,审评机构将直接调整保健功能声称及说明书相关内容,申请人无需补正。
四、保健功能未列入《功能目录 非营养素补充剂(2023年版)》的产品过渡
自公告发布之日起5年内,已注册但保健功能尚未纳入《功能目录非营养素补充剂(2023年版)》的产品,可根据《保健食品原料目录与保健功能目录管理办法》申请将相应保健功能纳入保健功能目录;或按照《保健食品注册与备案管理办法》申请变更保健功能,放弃未纳入《功能目录 非营养素补充剂(2023年版)》的保健功能,转换或增补符合《功能目录 非营养素补充剂(2023年版)》要求的保健功能。
五、注册证书“无有效期和无产品技术要求”的产品过渡
对于已批准注册的产品中注册证书“无有效期和无产品技术要求”的产品,省级市场监管部门应当根据产品实际生产的技术要求和监管情况,依据现行法律法规提出产品换发注册证书的意见,由注册人向审评机构申请转换或增补《功能目录 非营养素补充剂(2023年版)》内的保健功能声称,审评机构按照《食品安全法》及有关规定开展审评换证工作。
![]()















